Forum
Warto wiedzieć
Twoje Forum
Forum Giełda
+Dodaj wątek
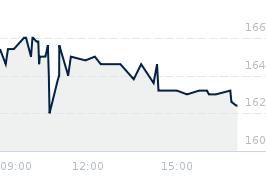
Opublikowano przy kursie:
192,60 zł
, zmiana od tamtej pory:
-25,44%
Scope Fluidics rozpoczął proces zmierzający do certyfikacji FDA systemu
Zgłoś do moderatoraCzas, jaki zajmuje przeprowadzenie całego procesu certyfikacji FDA, w tym badania kliniczne, testy analityczne oraz testy software’u i hardware’u, może się różnić w zależności od wielu czynników, takich jak złożoność urządzenia, gotowość technologii, dostępność zasobów oraz współpraca z FDA. Niemniej jednak, ogólnie rzecz biorąc, cały proces może trwać od kilku miesięcy do kilku lat. Oto przybliżony czas trwania poszczególnych etapów:
- Badania kliniczne – W zależności od rodzaju urządzenia i jego przeznaczenia, badania kliniczne mogą trwać od kilku miesięcy do kilku lat. Na przykład, jeśli urządzenie wymaga dużej liczby testów z udziałem pacjentów, proces ten może trwać dłużej. Zwykle jednak badania kliniczne na poziomie 510(k) są mniej rozbudowane niż w przypadku pełnej certyfikacji, ale nadal wymagają przeprowadzenia testów na ludziach, które mogą potrwać od 6 miesięcy do 2 lat.
- Testy analityczne – Testy laboratoryjne i analityczne, które sprawdzają dokładność, wydajność i bezpieczeństwo urządzenia, mogą potrwać kilka miesięcy. Czas ten zależy od rodzaju urządzenia oraz skomplikowania jego testowania.
- Testy software’u i hardware’u – Testowanie oprogramowania i sprzętu również jest kluczowe i wymaga czasu na wykrycie ewentualnych błędów i zapewnienie pełnej zgodności z wymaganiami FDA. Zwykle testy te trwają od kilku miesięcy do roku, w zależności od złożoności systemu.
- Złożenie wniosku i procedura 510(k) – Po zakończeniu badań i testów, przygotowanie dokumentacji i złożenie wniosku o certyfikat 510(k) może zająć kilka miesięcy. FDA zazwyczaj dokonuje oceny wniosku w ciągu 90 dni, ale cała procedura, w tym przygotowanie wszystkich dokumentów, może zająć do roku.
- Scope Fluidics rozpoczął proces zmierzający do certyfikacji FDA systemu
- Scope Fluidics rozpoczął proces zmierzający do certyfikacji FDA systemu
- Budowa półautomatycznej linii produkcyjnej w Mondragón (Hiszpania).
- Kurs Euro
- Kurs dolar
- Kurs frank
- Kurs funt
- Wiron
- Przelicznik walut
- Kantor internetowy
- Kalkulator wynagrodzeń
- Umowa zlecenie
- Kredyt na mieszkanie
- Kredyt na samochód
- Kalkulator kredytowy
- Revolut
- Winiety
- Jak grać na giełdzie?
- Jak wziąć kredyt hipoteczny?
- Rejestracja samochodu
- Jak rozwiązać umowę z Orange
- Koszty uzyskania przychodów
- Sesje elixir
- PB weekend
- RRSO co to jest?
- Blogbank.pl
- Promocje bankowe - zgarnijpremie.pl
- Stopa procentowa