Forum
Warto wiedzieć
Twoje Forum
Forum Giełda
+Dodaj wątek
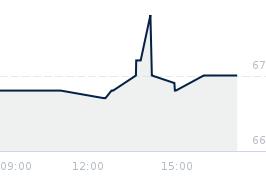
Opublikowano przy kursie:
98,50 zł
, zmiana od tamtej pory:
-1,52%
Re: Ja czekam na 90, a może nawet niżej.
Zgłoś do moderatoraWg. informacji przekazanych przez spółkę otrzymana z EMA lista pytań obejmuje pytania, na które Bioceltix „nie identyfikuje istotnych ryzyk wykraczających poza standardowe ryzyka związane z uzyskaniem MA” (MA Marketing Authorization to pozwolenie na dopuszczenie produktu leczniczego do obrotu na rynku europejskim, wydawane przez Europejską Agencję Leków EMA) i ma czas na odpowiedź do maja 2025 r
- Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Re: Ja czekam na 90, a może nawet niżej.
- Kurs Euro
- Kurs dolar
- Kurs frank
- Kurs funt
- Wiron
- Przelicznik walut
- Kantor internetowy
- Kalkulator wynagrodzeń
- Umowa zlecenie
- Kredyt na mieszkanie
- Kredyt na samochód
- Kalkulator kredytowy
- Revolut
- Winiety
- Jak grać na giełdzie?
- Jak wziąć kredyt hipoteczny?
- Rejestracja samochodu
- Jak rozwiązać umowę z Orange
- Koszty uzyskania przychodów
- Sesje elixir
- PB weekend
- RRSO co to jest?
- Blogbank.pl
- Promocje bankowe - zgarnijpremie.pl
- Stopa procentowa